Folytatódnak a heves harcok a Donyeck megyei Szoledar városáért
Az orosz erők a Donyeck megyei Bahmut irányában megpróbálják átvenni az ellenőrzést ...
A Székely Hírmondó terjesztését szeptember 1-jétől új csapat vette kézbe. Tudjuk, az utóbbi időben akadtak gondok a lapkézbesítés terén, remélhetőleg ezeket mielőbb orvosolni tudjuk, ezen dolgozunk. Addig is annak érdekében, hogy a jövőben zökkenőmentesen tudjuk eljuttatni postaládájába kedvenc napilapját, kérjük, legkésőbb az adott hónap utolsó napjáig rendelje meg a Székely Hírmondót a következő hónapra.
További jó hírrel is tudunk szolgálni: szeptember 12-től újra megnyitjuk sepsiszentgyörgyi ügyfélszolgálatunkat a Csíki u. 7. sz. alatt, ahol hétköznap 8 és 16 óra között állunk rendelkezésükre: apróhirdetést adhatnak fel, lapokat, folyóiratokat rendelhetnek meg, de minden téren igyekszünk a segítségükre lenni. A kézdivásárhelyi ügyfélszolgálat változatlanul a Függetlenség u. 1. sz. alatt működik ugyancsak 8 és 16 óra között.
Amennyiben a Székely Hírmondót többször is késve vagy netán egyáltalán nem kapja kézbe, kérjük, hívja bizalommal a 0728.048.136-os telefonszámot.
A Prima Press Kft. terjesztési osztálya nevében:
Balogh Kinga
 Külföld
Külföld
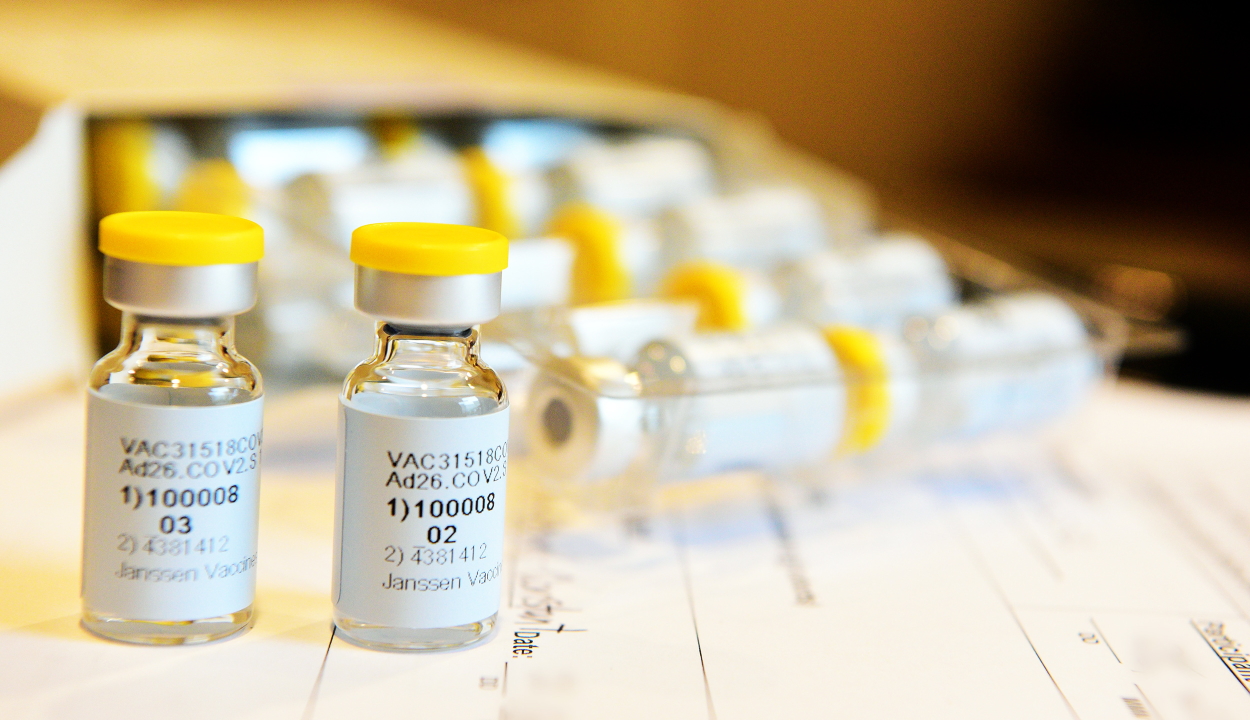
Ez a negyedik vakcina, amely az Európai Unió gyógyszerfelügyeleti hatóságának szerepét betöltő ügynökség ajánlása szerint hatékony a SARS-CoV-2 koronavírus ellen, de az első, amely egydózisú. Az ügynökség a vakcina alkalmazását 18 éves kortól ajánlja.
Az uniós ügynökség uniós ügynökség közleményében az áll: az EMA Humángyógyszer Bizottsága (CHMP) gyorsított eljárás keretében végezte a Johnson & Johnson COVID-19 Vaccine Janssen névű oltóanyag vizsgálatát, amelynek során értékelte a vakcina hatékonyságára és biztonságosságára, valamint minőségére vonatkozó, már rendelkezésre álló adatokat. Alapos értékelés során az EMA illetékes bizottsága arra a következtetésre jutott, hogy a vakcinára vonatkozó adatok megbízhatóak és megfelelnek a kritériumoknak, az oltóanyag azonnali rendelkezésre állásából származó előny egyértelműen meghaladja a gyógyszerrel összefüggő kockázatokat – közölték.
A rövidített értékelési folyamat azért volt lehetséges, mert az EMA korábban már megkezdte az oltóanyag folyamatos felülvizsgálatát.
Az amszterdami székhelyű EMA ez idáig a Pfizer amerikai gyógyszergyártó és partnere, a BioNTech német biotechnológiai cég által kifejlesztett vakcinát, a Moderna amerikai biotechnológiai vállalat oltóanyagát, valamint az AstraZeneca gyógyszeripari vállalat és az Oxfordi Egyetem által közösen kifejlesztett oltóanyagot ajánlotta forgalmazásra.
Az EU-s ügynökség mind a négy esetben gyorsított eljárás keretében hozta meg döntését, amely az oltóanyag egyéves feltételes alkalmazásához adja meg a zöld jelzést. Azt közölték, hogy a feltételes forgalomba hozatali engedély megadását célzó eljárás során a gyógyszerre vonatkozó vizsgálat a szokásoshoz képest kevésbé átfogó adatok alapján történik. Az engedély megadását követően a vállalatoknak bizonyos határidőn belül további, többek között a folyamatban lévő vagy új vizsgálatokból származó adatokat kell szolgáltatniuk annak megerősítésére, hogy az előnyök továbbra is meghaladják a kockázatokat.
A Johnson & Johnson oltóanyagában ártalmatlanított adenovírussal juttatják be a koronavírusra jellemző tüskefehérjét a szervezetbe. Az immunrendszer ezt követően idegen anyagként kezeli ezt a fehérjét, és természetes védekezésként antitesteket és a fehérvérsejtek csoportjához T-sejteket termel ellene. A vakcinában található adenovírus nem képes szaporodni, és nem okoz betegséget – közölték.
A már felhasználásra ajánlott oltóanyagokat gyártó vállalatok mellett ez idáig az orosz Szputnyik V fejlesztői kértek hivatalosan forgalombahozatali engedélyt az EMA-tól.
A folyamat felgyorsítása érdekében a gyógyszerügynökség megkezdte a Novavax amerikai és a német CureVac gyógyszeripari vállalatok által fejlesztett oltóanyagok, valamint csütörtökön az amerikai Eli Lilly gyógyszergyártó koronavírus elleni bamlanivimab és az etesemivab nevű gyógyszereinek folyamatos értékelését (rolling review) is.
Az Európai Bizottság csütörtökön feltételes forgalomba hozatali engedélyt adott a Janssen Pharmaceutica-Cilag NV gyógyszeripari vállalat új típusú koronavírus ellen kifejlesztett oltóanyagára, a Johnson & Johnson csoportba tartozó cég vakcinája a negyedik, amelynek megkezdődhet a tömeges alkalmazása az Európai Unióban.
Az Johnson & Johnson február 16-án nyújtott be forgalomba hozatali engedély iránti kérelmet az EMA-hoz. Az amerikai óriásvállalat oltóanyaga a negyedik vakcina, amely elérhetővé válik az Európai Unió 27 tagállamában a Pfizer/BioNTech, a Moderna és az AstraZeneca/Oxfordi Egyetem vakcinái után.
Az Európai Bizottság közleményében Ursula von der Leyen elnököt idézte, aki kijelentette, a feltételes forgalomba hozatali engedély megadásával újabb biztonságos és hatékony vakcinák érkeznek az unió piacára. Az újabb vakcina uniós alkalmazása elősegíti az oltási kampány fokozását már 2021 második negyedévében. Az engedélyezés egy újabb lépést jelent az unió azon közös céljának eléréséhez, hogy a felnőtt lakosság 70 százalékát nyár végéig beoltsák – tette hozzá von der Leyen.
A brüsszeli bizottság október 8-án kötött megállapodást a Johnson & Johnson vállalattal 200 millió adag oltóanyag beszerzéséről, további 200 millió dózis vásárlásának lehetőségével.
Az unió a Johnson & Johnson mellett ez idáig a BioNTech-Pfizer (600 millió adag), a Moderna (460 millió adag), az AstraZeneca (400 millió adag), a CureVac (405 millió adag) és a Sanofi-GSK (300 millió adag) vállalatokkal írt alá vakcinabeszerzésről szóló szerződéseket.
Ezen túlmenően az Európai Bizottság tájékozódó jellegű megbeszéléseket folytatott két másik gyógyszeripari vállalattal a koronavírus elleni oltóanyagok beszerzéséről, melyre azután kerülhet sor, hogy beigazolódott, a vakcina biztonságos és hatásos. A Novavax amerikai vállalattal 100 millió adag, a Valneva európai biotechnológiai vállalattal 30 millió dózis, és további 30 millió adag beszerzésének lehetőségével zárta le a
Az Európai Bizottság csütörtökön arról is tájékoztatott, hogy az uniós beszerzések révén ez idáig 60,7 millió adag vakcinát szállítottak a tagállamokba, amelyekből 43,1 millió adagot adtak be az embereknek.
A Janssen által kifejlesztett oltóanyag arra a technológiai platformra támaszkodik, amelyet már használtak a gyógyszergyár nemrégiben jóváhagyott, ebola elleni oltóanyagának, valamint a Zika-, az RSV- és a HIV-vírus elleni vakcinák kifejlesztéséhez és gyártásához.
(MTI)